神経細胞の電気的な活動の評価は、従来難しく技能習得にも長期間を要しました。Maestro MEA プラットフォームでは、iPS細胞から分化した神経細胞、培養神経細胞などの電気的な活動の評価を、簡単に行って頂くことができます。
プレート底面に埋め込まれた複数の微小電極を用いて神経細胞の電気的な活動を測定します。試薬、侵襲電極を使用しないラベルフリーの測定で、神経スパイクの発生から同期バーストの形成まで、細胞の成熟に伴う電気的な活動の変化を、数週間~数か月に渡って追うことが可能です。測定されたデータは専用ソフトで解析し、様々な指標による解析結果が得られます。
神経細胞培養内のネットワークは時間の経過に伴い成熟し、その活動は複雑化していきます。神経細胞活動には、活動電位の数と同期性によって特徴づけられるネットワーク・スパイク活動と、ネットワークにおける低周波振動を検出するLocal Field Potential(LFP)が含まれます。LFPとスパイク活動の同時測定(下左図参照)により、ネットワークの成熟に関するより詳細な情報を得ることが可能です。
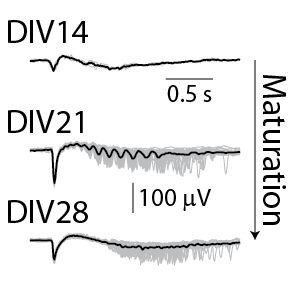
一般的なスパイク測定においては、培養14日後のラット皮質神経細胞から、個々の神経スパイク構成によるネットワーク活動を検出することができます。更に、LFP波形(下右図参照)により、培養細胞の成熟に伴うネットワーク活動の複雑化を見ることができます。
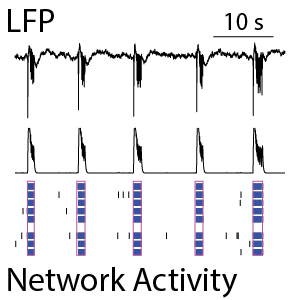
(左図) ラット神経細胞 (培養21日) から得られたスパイクラスタープロット (下段) 。青色は個々の電極で検出されたスパイクのバースト、ピンクは電極間で同期したバーストを示す。中段のスパイクヒストグラムにて、ネットワーク活動の振動が示される。上段は同時に検出されたLFPを示し、スパイクネットワーク活動(中・下段)と同期していることが分かる。
(右図)検出されたLFP。グレーは各LFPイベント、黒色は全LFPイベントの平均を示す。培養期間と共に変化しているのが分かる。DIV14におけるLFPシグナルは小さく、2極性で持続時間が短い。DIV21では振動が現われ、DIV28では、初期の強いピークに続き、そのリバウンドが異なる遅延で現れた。
神経細胞の発火(活動電位)とシナプスの活性は脳内神経細胞の基礎的な特性とされています。しかしながら、Neurobasal® Medium、DMEM/F-12 等の一般的な培地での培養環境下においては、神経細胞の生存は保たれるが、培養内におけるシナプスの活性は抑制されることが報告されています(Bardy et al. PNAS, 2015) 。BrainPhysTM Neuronal Medium 1は、培養環境下の神経細胞が、その電気的な活動を保持することを目的として開発されました。本事例では、iPS細胞由来神経細胞を、2種類の培地 (BraihPhysTM(緑)・DMEM/F-12/NeuroBasal-A (グレー))で18週間に渡り培養し、電気的な特性を比較しています。
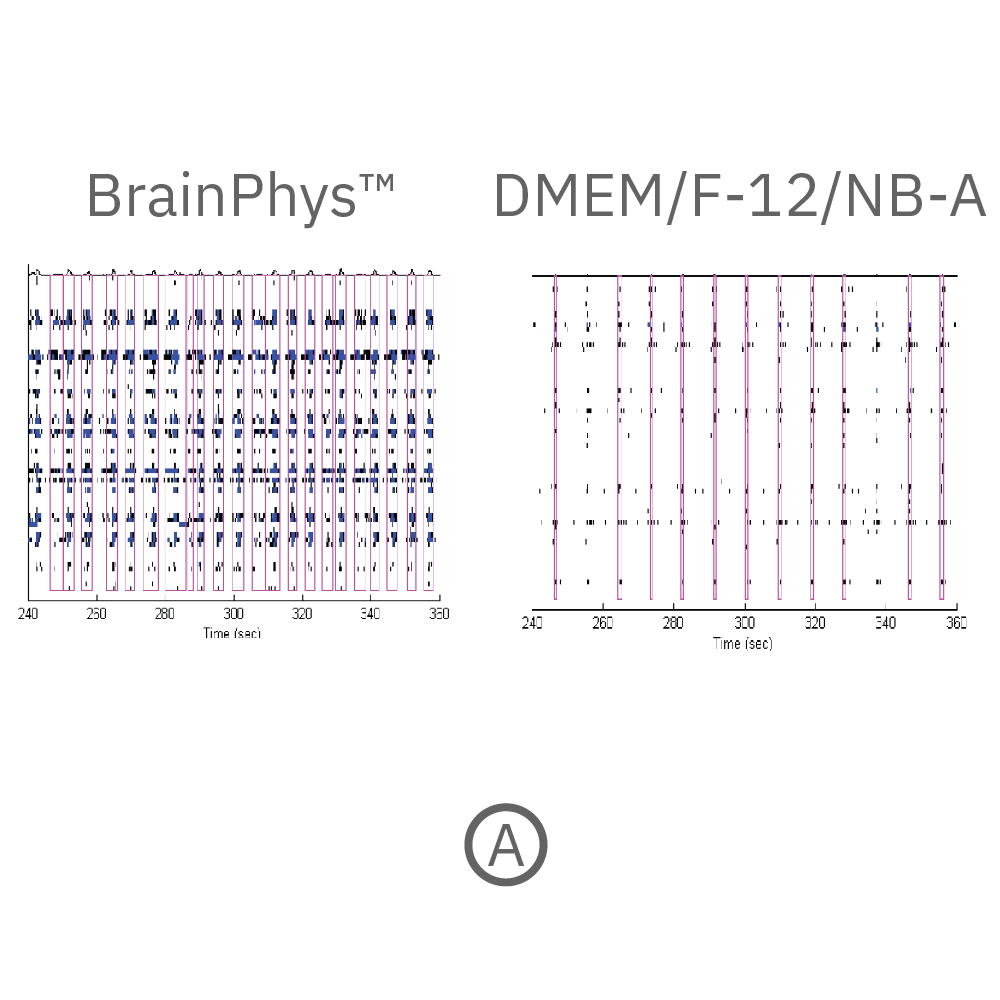
(A) 培養開始から18週間後に得られた神経スパイクのラスタープロット。黒点は検出されたスパイク、青色は、電極毎のバースト(各電極毎に5以上のスパイクが検出され、且つバースト内のスパイク間隔が100 ms 以下であることにより定義)を示す。ピンク色は電極間で同期したネットワークバースト(各 well 内の25%の電極から10以上のスパイクが検出。ネットワークバースト内のスパイク間隔が100 ms 以下であることにより定義)を示す。BrainPhysTM 培養下において、より多くの発火(スパイク)・バースト数が多く得られた。
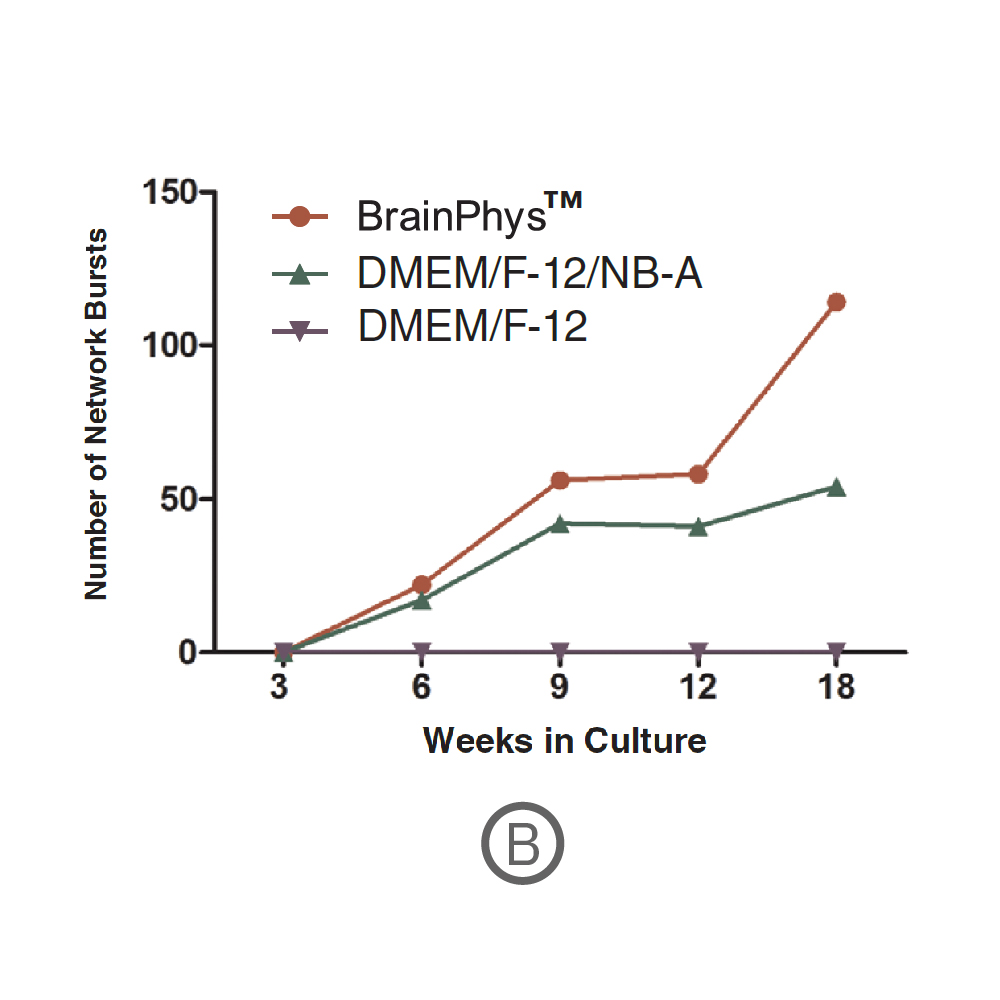
(B) ネットワークバースト数の経時的な変化を示す。ネットワークバーストは培養開始6週間後から検出され、18週間後には114 (BrainPhysTM)、54 (DMEM-F-12/NB-A) に達した(いずれも10分間測定時) 。データ提供 : STEMCELL Technologies, Mak et al. 2016 presented at SfN2016.
Maestro MEA を用いて、脳領域毎の神経細胞の電気的活動の違いを検証しました。マウスの脳領域毎に初代神経細胞培養を作成し、培養開始から4週間後に細胞外電位を測定したところ、各培養神経細胞からは異なるスパイクパターンが得られ、異なるネットワークパターンの形成が示れました。
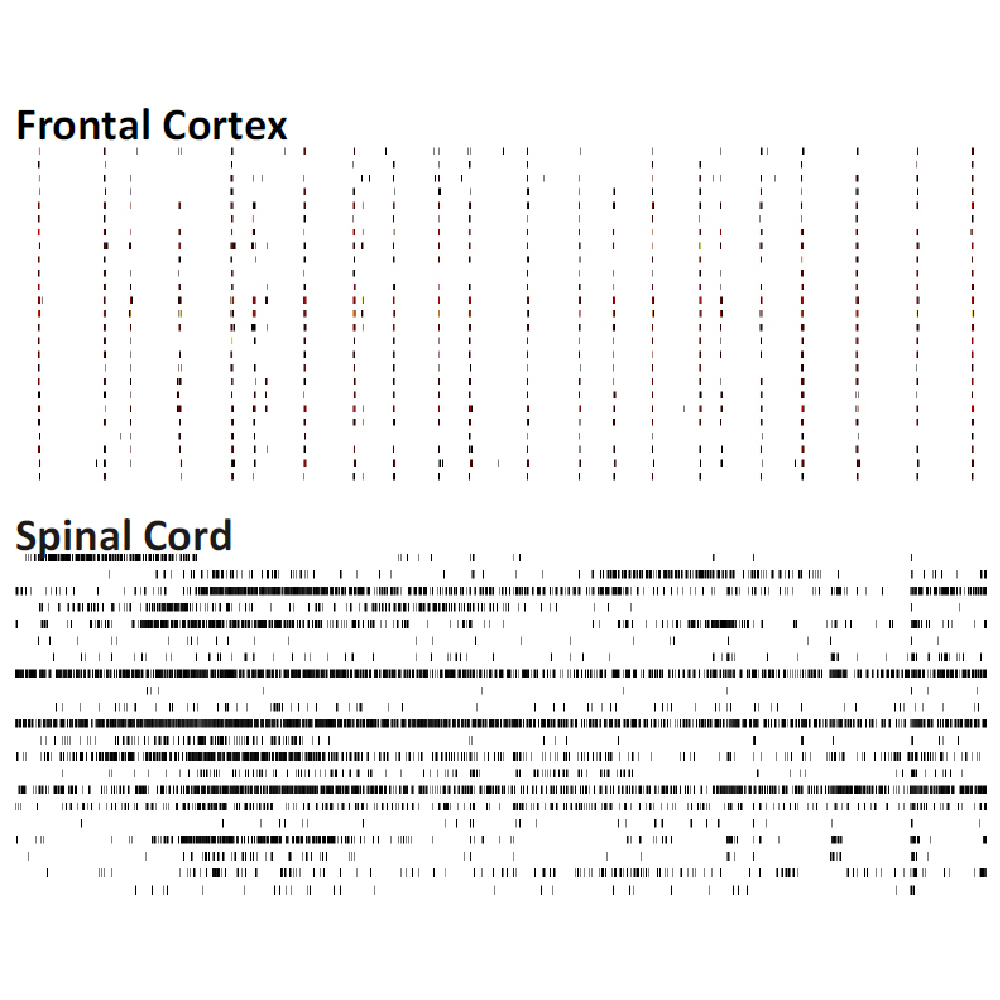
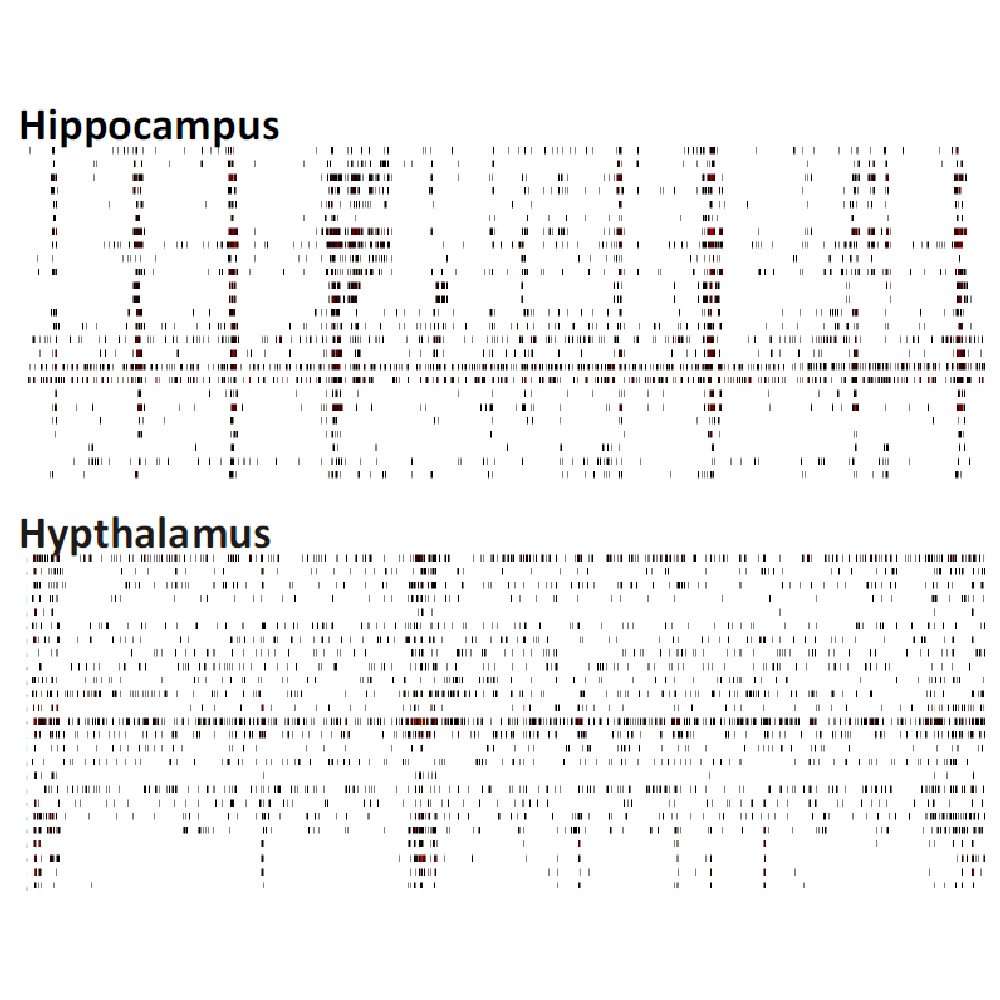

マウス胚芽組織の各領域 (前頭葉、海馬、中脳、脊髄 (DRG neuron)、視床、中脳+前頭葉共培養 )から分散培養を作成し、培養28日目に細胞外電位を測定した。図は60秒間の細胞外電位測定で検出されたスパイクのラスタープロットを示す。各領域ごとに特徴的なスパイクパターンが見られた。データ提供 : Neuroproof GMBH, (Voss et al. 2014 presented at SfN2014).
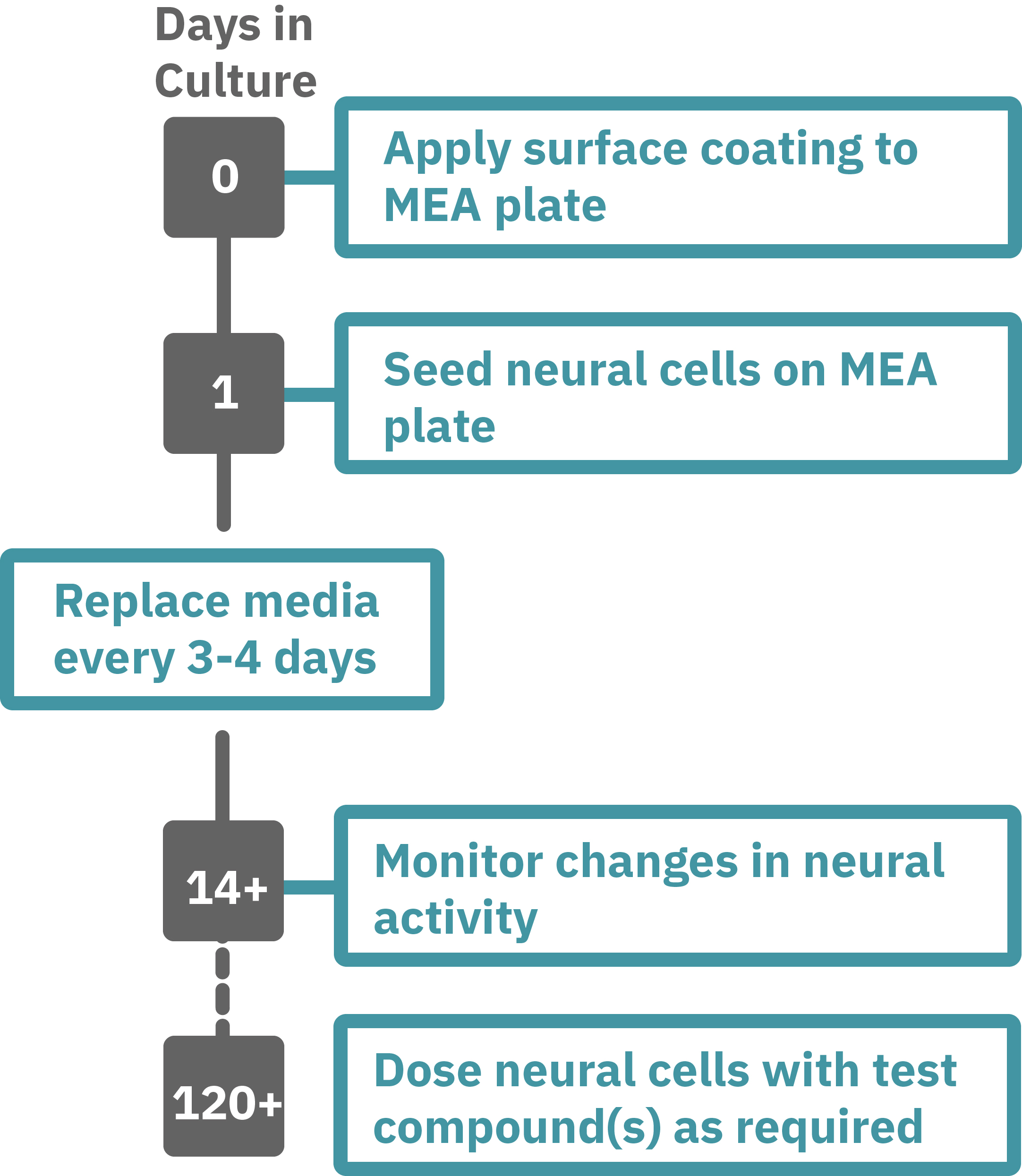
iPS細胞由来神経前駆細胞 (XCL1-NPC) を、poly-L-ornithine (PLO) 処理した 6-well 培養デッシュ上で、STEMdiffTM Neuron Differentiation Mediumを用いて5日間培養した。
5日後、神経前駆細胞を分散し、PLO/ラミニンでコーティングされたCytoView MEAプレートに播種 (30,000 cell/Cm2 in STEMdiff™ Neuron Differentiation Medium)した。
1日後、半量の培地を分化培地(BrainPhys™ Neuronal Medium + supplements: 1% N2 Supplement-A, 2% NeuroCult™ SM1 Neuronal Supplement, 20 ng/mL GDNF, 20 ng/mL BDNF, 1 mM db-cAMP and 200 nM Ascorbic Acid) に交換し、以降3-4日毎に半量交換を実施した。
Maestro MEAを用いて、37°C / 5% CO₂ の環境下で自発神経発火を測定した。測定は2週間毎に15分行い、測定データはAxIS Navigator 神経モジュールソフトウエア にて解析した。
Mak et al. 2016 (SfN2016)より






